Jodidy jsou soli kyseliny jodovodíkové (HI) obsahující jodidový aniont I− a kationt elektropozitivního prvku. Vazba mezi nimi je iontová. Různé druhy kationtů určují výsledné vlastnosti dané soli. Jsou to nejčastěji bezbarvé pevné látky, které se vyskytují v krystalových strukturách.
Příkladem anorganických jodidů s iontovou vazbou je jodid draselný (KI), používaný v medicíně nebo k jodizaci chloridu sodného. Dále jsou to jodid sodný (NaI), jodid stříbrný (AgI) nebo jodid měďnatý (CuI2). Převažující kovalentní vazbu má například jodid boritý (BI3).
Příkladem organických jodidů jsou kovalentní organické sloučeniny jodu a uhlíku (nejznámější jodmethan a jodoform). Aromatické jodidy (jodbenzen) se fotochemicky rozkládají na jodové a arylové radikály, které jsou schopné různých reakcí. Dále je to tetramethylamonium jodid a skupina látek nazývaných acyliomodidy.

V běžném životě se s jodidy setkáváme jako se složkou jodizované kuchyňské soli nebo v pilulkách předepisovaných při nedostatku jodu v organismu. Díky jodizaci soli prováděné od roku 1950 se již u lidí neprojevuje jeho nedostatek zejména v horských a suchozemských oblastech.
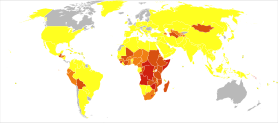
Tělo obsahuje asi 20–30 mg jodu, z tohoto množství je 80 % ve štítné žláze. Nedostatek jodu způsobuje výrazné zvětšení štítné žlázy (strumu) nebo mentální postižení (kretenismus). Denní příjem by měl být vyšší u dospívajících dětí (kolem 150 µg/den) a v těhotenství (180 µg/den). Celosvětově postihuje nedostatek jodu asi dvě miliardy lidí, především v rozvojových vnitrozemských oblastech.






